2C-G-5
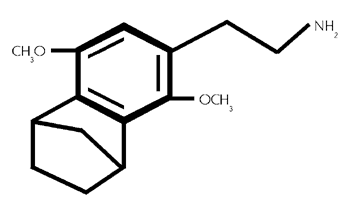
Formel aus:
(42/533)
Andere Namen:
3,6-Dimethoxy -4- (2-aminoethyl) -benzonorbornan. (42/532)
Dosis:
A. Shulgin gibt in seinem Meisterwerk "PHIKAL", dem Standardwerk ueber halluzinogene Phenethylamine und Amphetamine, einen Dosisbereich von 10-16 mg an. (42/534)
Wirkdauer:
Das Halluzinogen 2C-G5 wirkt sehr lange, naemlich 32-48h, wie die Untersuchungen von A. Shulgin, dem bekannten Drogenforscher und -designer, ergeben haben. (42/534)
Sucht:
Die Ausbildung einer koerperlichen Abhaengigkeit ist nicht bekannt. (eigen)
Synthese:
A. Shulgin gibt das Herstellungsverfahren dieses Halluzinogens in seinem Buch "PHIKAL" an:
Zu einer geruehrten Loesung von 25g 3,6-Dihydroxybenzonorbornan (von der Firma Eastman Kodak) in 200 ml Aceton wurden 200 mg Decyltriethylammoniumiodid, 40g gepulvertes, wasserfreies K2CO3 und 55g Methyliodid hinzugefuegt. Die Mischung wurde mit einem Heizmantel uebernacht am Rueckfluss gehalten. Nach Entfernen des Loesungsmittels im Vakuum wurde der Rest zu 2l H2O zugefuegt, mit konz. HCl angesaeuert, und mit 3x100 ml CH2Cl2 extrahiert. Die vereinten Extrakte wurden mit 2x150 ml 5%-iger NaOH und einmal mit verd. HCl gewaschen. Das Loesungsmittel wurde im Vakuum entfernt, um 19g schwarzes Oel als Rest zu ergeben. Dieses wurde bei 90-115 Grad Celsius mit einen Druck von 0.3mm/Hg destilliert, um 15.5g oranges Oel zu ergeben, dass einen kristallinen Feststoff bildete. Das Produkt, 3,6-Dimethoxybenzonorbornan, hatte einen mp von 35-37 Grad Celsius aus Hexan oder 40-41 Grad Celsius aus MeOH.
Eine Loesung von 4.6g POCl3 und 4.6g N-Methylformanilid wurde kurz auf dem Dampfbad erhitzt, bis sie dunkelweinrot geworden war. Es wurden dann 3.05g 3,6-Dimethoxybenzonorbornan hinzugefuegt. Die Loesung wurde auf dem Dampfbad 12h lang erhitzt. Die schwarze, teerige Reaktionsmischung wurde in H2O gegossen. Nach der Hydrolyse wurde das H2O dekantiert. Die unloeslichen Reste wurden abwechselnd mit H2O und mit CH2Cl2 gewaschen. Die vereinten Waschungen wurden getrennt. Die waessrige Phase wurde mit 2x50 ml CH2Cl2 extrahiert. Die vereinten organischen Fraktionen wurden mit 5%-iger NaOH gewaschen. Das Loesungsmittel wurde im Vakuum entfernt. Der fluessige, schwarze Rest wurde bei 130-140 Grad Celsius mit einem Druck von 0.3mm/Hg destilliert, um 1.17g beinahe weisses Oel zu ergeben. Dies wurde in 1ml MeOH geloest, und auf -50 Grad Celsius abgekuehlt, um einen weissen kristallinen Feststoff zu ergeben, der durch Filtration entfernt, sparsam mit -50 Grad Celsius MeOH gewaschen und an der Luft getrocknet wurde. Es wurden 0.83g 3,6-Dimethoxy-4-formylbenzonorbornan mit einem mp von 37-40 Grad Celsius erhalten, der auf 53-54 Grad Celsius gesteigert werden konnte, durch verschwenderisches Umkristallisieren aus MeOH. Eine gruendliche Mischung von diesem Produkt mit dem anfaenglichen Diether (mp 40-41 Grad Celsius) war eine Fluessigkeit bei Zimmertemperatur.
Zu einer Loesung von 3.7g 3,6-Dimethoxy-4-formylbenzonorbornan in 20g Nitromethan wurden 1.3g wasserfreies Ammoniumacetat hinzugefuegt. Die Mischung wurde auf dem Dampfbad 45 Min. lang erhitzt. Die ueberschuessigen Reagentien und das Loesungsmittel wurden im Vakuum entfernt. Der Rest wurde in 20 ml kochendem MeOH geloest. Ein Stueckchen eines Samenkristalls startete eine betraechtliche Kristallisation oranger Kristalle, welche durch Filtration entfernt und mit MeOH gewaschen wurden. Nach Trocknen, war das Produkt 3,6-Dimethoxy-4-(2-nitrovinyl)benzonorbornan gelb, wog 3.47g, und hatte einen mp von 88-89 Grad Celsius. Umkristallisieren eines analytischen Beispiels aus MeOH verbesserte diesen mp nicht.
Eine Loesung von LAH (46ml einer 1M Loesung in THF) wurde, unter He, auf 0 Grad Celsius mit einem aeusseren Eisbad abgekuehlt. Unter guten Ruehren wurden 1.25ml 100%-ige H2SO4 tropfenweise hinzugefuegt, um das Verkohlen gering zu halten. Es folgte eine Zugabe von 3.4g 3,6-Dimethoxy-4-(2-nitrovinyl)benzonorbornan in 30 ml wasserfreiem THF. Nach wenigen Min. weiteren Ruehrens, wurde die Temperatur auf einen sanften Rueckfluss am Dampfbad 10 Min. lang gebracht. Dann wurde alles wieder auf 0 Grad Celsius abgekuehlt. Das ueberschuessige Hydrid wurde durch die vorsichtige Zugabe von 7ml IPA zerstoert, gefolgt von 2ml 15%-iger NaOH und 5ml H2O, was einen leicht zu filtrierenden, weissen und koernigen Feststoff ergab. Dieser wurde durch Filtration entfernt. Der Filterkuchen wurde mit THF gewaschen. Die vereinten Filtrate und Waschungen wurden vom Loesungsmittel im Vakuum befreit, was ein blass bernsteinfarbenes Oel ergab, welches bei 150-160 Grad Celsius mit einem Druck von 0.3mm/Hg destilliert wurde, um 1.45g weisses Oel zu ergeben. Dieses wurde in 7ml IPA geloest, und mit 15 Tropfen konz. HCl neutralisiert. Es wurden dann 25ml wasserfreier Et2O hinzugefuegt. Nach einer kurzen Pause bildeten sich spontan weisse Kristalle. Diese wurden durch Filtration entfernt, mit Et2O gewaschen und an der Luft bis zu einem konstantem Gewicht getrocknet. Es gab eine Ausbeute von 1.13g 2C-G-5-HCl. Der mp war 199-200 Grad Celsius. Anal. (C15H22ClNO2) C,H. (42/532ff.)
Wirkungen:
A. Shulgin hat folgende subjektiven Wirkungsbeschreibungen gesammelt, die er in seinem Buch "PHIKAL" auffuehrt:
14 mg: Ich spuerte etwas nach 2h. Ich wollte absolut nicht fahren, oder auch nur aus dem Haus gehen. Ich wurde fortgesetzt an 2C-B mit seinem erotischen Schub erinnert, und an die milde Wechselwirkung der Farben und anderer visueller Wirkungen. Aber es wirkt viel laenger. Ich bin auf einem vollen 3+, sehr stoned, und es gibt keine glaubbaren Signale des Nachlassen fuer einige weitere Stunden. Es gibt einen guten Appetit (wieder, 2C-B aehnlich), und ich schaffte es fuer wenige Stunden zu schlafen. Den ganzen naechsten Tag war ich benommen und wahrscheinlich immer noch auf einem +. Am darauffolgenden Tag war ich schliesslich auf einer glaubwuerdigen Basislinie. Beide dieser Tage waren mit dem gefuellt, was man 'Mikro-eindoesen' nennen koennte, beinahe wie Narkolepsie. Vielleicht leide ich unter ein wenig Schlafmangel. (42/534)
16 mg: Die ersten Wirkungen wurden in 1h gefuehlt, und die vollen Wirkungen zwischen 2,5-3h. Fuerchterliche Gedankenklarheit, kosmisch aber erdverbunden, so war es. Dies ist nicht ganz gleich wie LSD. Es ist ein wenig weicher als die 2C-T Familie. In den naechsten wenigen Stunden war es koestlich und spassig. Ich fuehlte mich sicher und gut gelaunt. Ich ging ohne Probleme schlafen, waehrend ich immer noch auf einem 3+ war. Meine Traeume waren positiv und ausgeglichen, aber ich erwachte reizbar und gefuehlsmaessig abgestumpft. Ich wollte mit niemandem interagieren. Die ersten 16h auf dieser Droge waren grossartig, und die zweiten 16h waren ein bisschen eine Schlepperei. Gerade 2x so lang, wie es sein sollte. (42/534)
16 mg: Ich war auf einem vollen Funkeln in 3h, und der Hoehepunkt setzte sich fuer eine laengere Zeit fort. Die Muedigkeit, die nach einer Weile kommt, spiegelt wahrscheinlich die Unzulaenglichkeit des Schlafs wieder. Ich war mir nach 2 Tagen immer noch irgendeiner Wirkung bewusst. (42/534)
Allgemeines:
Das Halluzinogen 2C-G5 ist von der chemischen Struktur her ein Phenethylamin. Es ist damit chemisch nahe verwandt mit 2C-B, 2C-E, Meskalin,... Die einzelnen, psychoaktiven Phenethylamine unterscheiden sich nur durch die Art der Substituenten voneinander. (eigen)
Haengt man bei einem Phenethylamin noch eine Methylgruppe an der Ethylaminseitengruppe an, kommt man zu der Gruppe der Amphetamine. Grundsaetzlich scheint die Regel zu gelten, dass wenn ein Phenethylamin psychoaktiv ist, ist auch sein Amphetamingegenstueck wirksam ist. Mehr noch, es ist sogar allgemein staerker. (eigen)
A. Shulgin gibt ausserdem noch folgende Kommentare zu diesem Halluzinogen an:
In einer moeglichen Aussage ueber die Staerke einer Droge, muss nicht nur die Dosis, die gebraucht wird, beachtet werden, sondern auch die Wirkungsdauer. So gesehen, ist dieses Phenethylamin ein Rekordbrecher, in dem, dass es nicht nur unter den wirksamsten ist, sondern es wirkt und wirkt und wirkt. (42/534f.)
Der Chemiker A. Shulgin gibt ausserdem noch ein paar chemische Kommentare an:
Erstens, die miserable Phenol-zu-Ether-zu-Aldehyd Serie von Schritten, so aufreizend unbefriedigend in der 2C-G-4 Synthese, war hier komplett angenehm. Die Reaktion lief. Die Ausbeuten waren zufriedenstellender. (42/534f.)
Zweitens ist dies eines der wenigen Phenethylamine, dass ein Racemat ist. Die eigenartige Geometrie des Norbornanrings traegt einen chiralen Charakter in sich. Damit ist diese Verbindung potentiell in 2 optisch aktive Formen trennbar. Aber ich vermute, dass es ausgesprochen schwierig sein wird, die beiden Formen zu trennen. (42/534f.)