DOPR
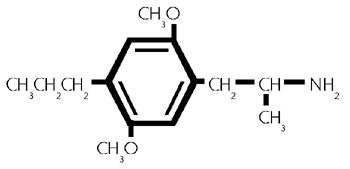
Formel aus:
(42/647)
Andere Namen:
2,5-Dimethoxy -4-(n)- propylamphetamin. (42/647)
Allgemeines:
DOPR ist ein halluzinogenes Amphetamin. Es reiht sich damit in eine Gruppe halluzinogen hochaktiver Verbindungen ein. Chemisch nahe Verwandte waeren DOM, DOB, DOC, um nur einige zu nennen. Es grenzt sich gleich, wie alle anderen halluzinogenen Amphetamine von den als Stimulantien eingesetzten Amphetaminen dadurch ab, dass es Substituenten am aromatischen Benzolring besitzt, im Gegensatz zu Amphetamin und Methamphetamin, den bekanntesten zentralwirksamen Stimulantien, die oftmals einfach nur als "speed" bezeichnet werden. DOPR ist damit von der Wirkung naeher mit Meskalin und dem chemisch sehr unterschiedlichen LSD verwandt, als mit den Aufputschmitteln, denen ein eigenes Buch mit dem Titel "Lexikon der antriebssteigernden Rauschdrogen." von mir gewidmet wurde. (eigen)
Alexander Shulgin schreibt in "PHIKAL", seinem Standardwerk ueber halluzinogene Phenethylamine und Amphetamine, ueber das wenig bekannte Halluzinogen DOPR:
Es gibt einen Faden von Zusammenhangslosigkeit und von widerspruechlichen Verweisen, die die meisten der Berichte durchdringen, die ich empfangen habe und den Gebrauch von DOPR betreffen. Es gibt ein Treiben zu einem Ort, der zwischen einem nicht-ganz-wachen und einem nicht-ganz-eingeschlafenen Status liegt, der diese Verbindung zu charakterisieren scheint. Es ist keine Frage, dass es sehr potent und sehr langwirkend ist. Die halluzinogenen Wirkungen werden mit Anfluegen von Gedaechtnisschwund beeintraechtigt. Wenn DOPR dies zeigt, mit seiner 3-Kohlenstoff Alkylgruppe, gibt es genug Grund darauf zu achten, wenn die Kette laenger werden sollte. (42/649f.)
Es gibt eine reiche Sammlung von falschen Berichten und moeglichen Entdeckungen, die mit dem Isopropylabkoemmling assoziert werden. Dieses strukturelle Isomer, 2,5-Dimethoxy-4-(i)-propylamphetamin wird richtig DOIP (steht fuer Des-oxy-iso-propyl) genannt. Es wurde synthetisiert und in Tieren untersucht, und in bescheidenen Masse auch am Menschen. Die Synthese begann bei 2,5-Dimethoxyacetophenon durch Addition einer Methylgruppe am Carbonyl, gefolgt von Reduktion zum Hydrocarbon. Aldehydbildung, Nitropropensynthese mit Nitroethan, und Reduktion mit Lithiumaluminumhydrid verliefen ereignislos, das Hydrochloridsalz DOIP ergebend, dass einen mp von 183-184 Grad Celsius, als analytisches Beispiel, hatte. Tierversuche (wie Hyperthermietests an Hasen) haben aufgezeigt, dass die Isopropylverbindung DOIP weniger potent als der Propylprototyp DOPR ist, zwischen einer und zwei Groessenordnungen. Im Menschen, waere eine Dosis von 4 mg eine ueberwaeltigende Dosis DOPR, ist jedoch mit DOIP ohne irgendeine Wirkung. Mit 10 mg gibt es einige Erregung, aber keine wirkliche Wirkung. Mir wurde erzaehlt, dass es mit Dosen im 20-30 mg Bereich stichhaltige Aenderungen im mentalen Status gibt, aber die Natur von diesen Veraenderungen wurde mir nicht genannt. (42/649f.)
Dosis:
A. Shulgin gibt die Dosis dieser Verbindung mit 2.5-5 mg an. (42/648)
Wirkdauer:
Die Dauer der Wirkung betraegt 20-30h, wie A. Shulgin festgestellt hat. (42/648)
Wirkungen:
A. Shulgin veroeffentlichte folgende subjektiven Wirkberichte in seinem Werk "PHIKAL":
5 mg: Es ist nun Mitternacht, und immer noch ein starkes +++. Dies ist sicherlich die maximale Dosis, wenigstens fuer eine lange Zeit. Es gibt schwache Andeutungen von Nervensystemstoerungen. Du weisst, die Art von Ding, die eine Rolle spielen, dass es eine Weile dauern wird, bevor du versuchen wirst in den Schlaf zu entspannen. Diese Droge, aehnlich wie alle anderen DO's, ist ein Hochleistungshalluzinogen. Etwas Indolaehnlich in diesem Fall. Dein Koerper als auch dein Geist sagen dir, dass du darauf bist, und besser entspannst und den Trip geniesst, weil du die Kueste weit hinter dir gelassen hast. Als es Zeit war zu Bett zu gehen, ging ich schlafen mit ueberrraschender Einfachheit, und schlief nur rund 6h. Meine Traeume waren ausgezeichnet, ausgeglichen, und gutgelaunt. Aber am naechsten Tag erkannte ich, dass ich immer noch das DOPR in mir trug, und dass die Basislinie tatsaechlich nicht hier war. Aber es war OK. Keine Probleme, ausgenommen die Schlaefrigkeit. Am naechsten Abend ging ich zu Bett um 9 am Abend und schlief 13h lang. Faszinierende Verbindung, aber ich werde meinen Weg nicht verlassen, um es bald wieder zu nehmen. (42/648f.)
Sucht:
Die Ausbildung einer koerperlichen Abhaengigkeit ist nicht bekannt. (eigen)
Synthese:
A. Shulgin gibt folgendes Herstellungsverfahren in seinem Werk "PHIKAL" an:
Eine Suspension von 285g moosartigen Zink in 285 ml H2O, dass 5.7g Quecksilberchlorid beinhaltete, wurde mit 285ml konz. HCl versetzt und geschuettelt, wie benoetigt um die Amalgamierung zu bewirken. Das H2O wurde dann abgetropft. Das Zink wurde mit frischem Wasser gewaschen und nochmals abgetropft. Es wurde eine Loesung von 74g 2,5-Dimethoxypropiophenon in 140g EtOH hinzugefuegt. Die Reaktionsmischung wurde fuer 24h am Rueckfluss gehalten mit der periodischen Zugabe von konz. HCl. Sie wurde dann abgekuehlt, mit H2O und CH2Cl2 verduennt, und die organischen Phasen getrennt. Die waessrige Phase wurde mit 2x100 ml zusaetzlichem CH2Cl2 extrahiert. Die vereinten organischen Phasen wurden mit 5%-iger NaOH gewaschen, bis die Waschungen basisch blieben, dann einmal mit H2O. Dann wurde das Loesungsmittel im Vakuum entfernt. Der Rest wurde an der Wasserstrahlpumpe destilliert, was eine fruehe Fraktion, sehr reich an urspruenglichen p-Dimethoxybenzol, und eine zweite Fraktion (61g, Siedepunkt 140-160 Grad Celsius), die frei war von der Carbonylgruppe durch Infrarot, und welche ueberwiegend 2,5-Dimethoxypropylbenzol war, ergab. Es wurde ohne weitere Reinigung im naechsten Aldehydsyntheseschritt eingesetzt.
Eine Mischung von 124g N-Methylformanilid und 140 g POCl3 wurde es erlaubt zu stehen, bis es eine Entwicklung von stark roter Farbe gab. Es wurden dann 60g 2,5-Dimethoxypropylbenzol hinzugefuegt. Die Mischung wurde fuer 2h am Dampfbad belassen. Die Mischung wurde zu 2l H2O zugefuegt und geruehrt, bis sich das ueberschuessige Saeurechlorid komplett zersetzt hatte. Die Mischung wurde mit 3x100 ml CH2Cl2 extrahiert. Nach Entfernen des Loesungsmittels von den vereinten Extrakten, wurde der Rest mit 3x100 ml kochendem Hexan extrahiert. Das Entfernen des Loesungsmittels gab das Produkt 2,5-Dimethoxy-4-propylbenzaldehyd, als Oel, 23g schwer, dass als Malononitrilderivat dargestellt wurde. Gleiche Gewichte vom Produkt und Malononitril in EtOH mit einer katalytischen Menge an Triethylamin ergaben gelbe Kristalle, welche nach Umkristallisierung aus Toluol einen mp von 113-114 Grad Celsius hatten.
Eine Loesung von 21.5g vom obigen, rohen 2,5-Dimethoxy -4- propylbenzaldehyd in 75g Essigsaeure, wurde mit 10.4g Nitroethan und 6.6g wasserfreiem Ammoniumacetat versetzt. Dies wurde fuer 1.75h am Dampfbad erhitzt, dann abgekuehlt und mit H2O verduennt bis zur Truebung. Nach langem Stehen und Kratzen, ergab sich schliesslich die Ablagerung von Kristallen, die durch Filtration entfernt und so trocken wie moeglich abgesaugt wurden. Diese 23g eines rohen Produktkuchens wurden unter MeOH zermahlen, nocheinmal filtriert, und an der Luft getrocknet, um 11g stumpf oranger Kristalle zu ergeben. Umkristallisierung aus kochendem MeOH ergab 1-(2,5-Dimethoxy -4-(n)- propylphenyl) -2-nitropropen, als feine orange Kristalle, die nach Filtration, Waschen und Trocken, 7.4g wogen, und die einen mp von 94-96 Grad Celsius hatten.
Zu einer Suspension von 6g LAH in 500 ml wasserfreiem Et2O, die geruehrt und auch auf einem sanften Rueckfluss gehalten wurde, wurde eine gesaettigte Loesung von (2,5-Dimethoxy- 4-(n)- propylphenyl) -2- nitropropen in warmen THF hinzugefuegt. Die Reaktionsmischung wurde fuer 24h am Rueckfluss gehalten, dann auf Raumtemperatur abgekuehlt. Das ueberschuessige Hydrid wurde durch die vorsichtige Zugabe von 500 ml verd. H2SO4 zerstoert. Die Phasen wurden getrennt. Die waessrige Phase wurde mit zusaetzlichem Et2O gewaschen. Es wurden dann 150g Kalium-Natriumtartrat hinzugefuegt. Der pH-Wert wurde mit waessriger NaOH auf >9 gebracht. Das Produkt wurde mit Et2O extrahiert. Nach Entfernen des Loesungsmittels, wurde der Rest in 200 ml wasserfreien Et2O geloest und mit wasserfreiem HCl Gas gesaettigt. Die Feststoffe, die sich bildeten, wurden durch Filtration entfernt, was 6.15g DOPR-HCl, als elektrostatisches, weisses und kristallines Pulver, mit einem mp von 182.5-183 Grad Celsius, ergab. Dieser wurde nicht durch Umkristallisieren aus IPA oder CH3CN verbessert. (42/647f.)