Ganesha
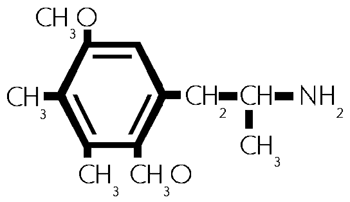
Formel aus:
(42/678)
Andere Namen:
G, 2,5-Dimethoxy -3,4- dimethylamphetamin. (42/678)
Allgemeines:
Ganesha, benannt nach dem elephantengesichtigen hinduistischen Gott der Weisheit, ist von der chemischen Struktur her ein halluzinogenes Amphetamin und unterscheidet sich von den zentralstimulierenden Amphetaminen durch seine Substituenten am aromatischen Benzolring, welche bei den stimulierenden Amphetaminen fehlen. Es ist damit naeher zu den Halluzinogenen Meskalin und dem chemisch sehr verschiedenartig aufgebauten LSD verwandt, als zu den strukturell aehnlicheren Aufputschmitteln, denen ein eigenes Buch mit dem Titel "Lexikon der antriebssteigernden Rauschdrogen" von mir gewidmet wurde. Halluzinogene Amphetamine gibt es uebrigens sehr viele. Die bekanntesten Vertreter sind DOM (STP), DOB, und TMA. (eigen)
Ganesha gehoert nun zu jenen Halluzinogenen, die von dem amerikanischen Drogenforscher und -designer A. Shulgin entwickelt und getestet wurden. (42)
A. Shulgin gibt folgende, spezielle, Kommentare zum Halluzinogen Ganesha an:
Dieser Stoff war der siebte von den 10 moeglichen klassischen Damen. Ich habe das Konzept schon bei der Diskussion von ARIADNE erwaehnt. Dies ist der germanische Ersatz von jedem der unterscheidbaren Wasserstoffatome von DOM mit einer Methylgruppe. Der Befund mit GANESHA war eine totale Ueberraschung. Die Erweiterung von einem Wasserstoff in der 3. Position von DOM mit einer Methylgruppe sollte wenig Einfluss auf die sterische Vereinigung mit ihrem Receptorsitz haben, welcher auch verwickelt sein mag. (42/679f.)
Dosis:
A. Shulgin gibt die Dosis in seinem Buch "PHIKAL" mit 20-32 mg an. (42/679)
Wirkdauer:
Die Dauer der Wirkung dieses Halluzinogens wird von A. Shulgin mit 18-24h angegeben. (42/679)
Wirkungen:
24 mg: Es gab ein langsames Steigen zu einem ++ oder mehr in rund 3h Dauer. Extrem ruhig, und kein Hinweis auf irgendeine Koerpergiftigkeit. Mehr wie ruhig, ich war komplett im Frieden, in einem schoenen, freundlichen, und ruhigen Platz. Es gab einigen Rest, der sich in die Schlafperiode ausdehnte, und war moeglicherweise immer noch da am Morgen. Wahrscheinlich war ich einfach muede vom ungenuegenden Schlaf.
32 mg: Eine schnelle und volle Entwicklung. Darniederliegen mit Musik, die Bilder mit geschlossenen Augen waren einfach etwas. Es gab ploetzlich Kenntnis von einem moeglichen Krampf im Zeh, welchen ich moeglicherweise ueberbewertete, aber es trudelte weiter in meinem Bewusstsein, und es keilte sich in mit meiner visuellen Vorstellung irgendwie fest. Es war nicht einfach, die visuellen/koerperlichen/kognitiven Welten in ihren passenden Plaetzen zu halten. Der beinahe-Krampf ging vorbei und ich vergass ihn. Es gab einen Rueckenkrampf irgendwo in diesem Drama, und es spielte wirklich keine Rolle. Diese Dosis mag ein bisschen viel fuer gute Hausarbeit sein! Gegen Ende des Experiments schaute ich auf eine Sammlung von Photos von einer kuerzlichen Reise nach Europa, und die visuelle Intensivierung war wunderbar. Ein rollendes +++. (42/679)
Sucht:
Die Ausbildung einer koerperlichen oder psychischen Abhaengigkeit ist nicht bekannt. (eigen)
Synthese:
A. Shulgin fuehrt folgendes Syntheseverfahren in seinem Hauptwerk "PHIKAL" an:
Eine Loesung von 15.4g 2,5-Dimethoxy -3,4- dimethylbenzaldehyd in 50 ml Nitroethan wurde mit 3g wasserfreiem Ammoniumacetat versetzt und am Dampfbad 12h erhitzt. Das ueberschuessige Nitroethan wurde im Vakuum entfernt. Das restliche Oel wurde mit der gleichen Menge MeOH verduennt. Es gab die langsame Bildung von tiefroten, huettenkaeseartigen Kristallen, welche durch Filtration entfernt und zu einem konstanten Gewicht von 9.3g luftgetrocknet wurden. Die Kristalle hatten einen mp von 71-74 Grad Celsius. Umkristallisieren aus MeOH (10 ml/g) ergab ein analytisches Beispiel von 1-(2,5-Dimethoxy-3,4-dimethylphenyl)-2-nitropropen mit einem mp von genau 82 Grad Celsius. Das NMR Spektrum (in CDCl3) und CI Massenspektrograph (MH+=252) waren passend.
Zu einer Suspension von 3.3g LAH in 200 ml am Rueckfluss kochendem THF, die kraeftig geruehrt und unter einer Inertatmosphaere gehalten wurden, fuegte man 4.2g 1-(2,5-Dimethoxy-3,4-dimethylphenyl)-2-nitropropen in 25ml THF hinzu. Die Mischung wurde 48h am Rueckfluss gehalten. Nach dem Abkuehlen, wurden vorsichtig 3.3ml H2O hinzugefuegt, um das ueberschuessige Hydrid zu zersetzen, gefolgt von 3.3ml 15%-iger NaOH und schliesslich noch 10 ml H2O. Die anorganischen Feststoffe wurden durch Filtration entfernt, und mit zusaetzlichem THF gewaschen. Die vereinten Filtrate und Waschungen wurden vom Loesungsmittel im Vakuum befreit. Der Rest, 4.7g dunkles, bernsteinfarbenes Oel, wurden in verd. HCl geloest. Dies wurde mit 3x75ml CH2Cl2 gewaschen, dann mit 5%-iger NaOH basisch gemacht und mit CH2Cl2 extrahiert. Das Entfernen des Loesungsmittels im Vakuum ergab ein bernsteinfarbenes Oel, dass destilliert wurde (105-115 Grad Celsius bei 0.4mm/Hg), um 1.2g von einem weissen Oel zu erhalten. Dies wurde in 8ml IPA geloest, mit 15 Tropfen konz. HCl neutralisiert, und mit 250 ml wasserfreiem Et2O verduennt. Nach einer Zeit gab es eine ploetzliche Erscheinung von weissen Kristallen, welche durch Filtration entfernt wurden, mit Et2O gewaschen und dann luftgetrocknet wurden. Es wurden 1g GANESHA-HCl, mit einem mp von 168-169 Grad Celsius, erhalten. Dieser wurde weder durch Umkristalliseren aus EtOAc oder Nitroethan verbessert. Anal. (C13H22ClNO2) N. (42/678f.)