TMA-4
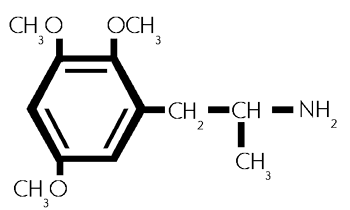
Formel aus:
(42) Andere Namen:
2,3,5-Trimethoxyamphetamin. (42)
Allgemeines:
Dieses Halluzinogen ist ein halluzinogener Amphetamin-abkoemmling, der sich von seinen stimulierenden Verwandten durch eine Substitution am Benzolring unterscheidet. Dies macht diese Droge erst halluzinogen. (eigen)
Dies ist eigentlich eine wenig untersuchte halluzinogene Rauschdroge, doch lassen wir A. Shulgin zu Wort kommen, der die Literatur ueber diese Substanz zusammenfasste:
Das ist die ganze Summe des Wissens ueber subjektive Wirkungen, dass existiert. Da war solch eine wertvolle, kleine Menge des endgueltigen Hydrochloridsalzes, dass bis zum Ende der Aufbauzeit der Dosis, fuer diesen einzelnen Versuch gerade noch genug uebrig war, der in Suedamerika durchgefuehrt wurde. Basierend auf dem freiwilligen Vergleich mit LSD und TMA, wurde eine Wirksamkeit fuer diese Verbindung veroeffentlicht, die behauptet, dass es 4x so potent wie Meskalin ist, oder 4 M.U. (Meskalineinheiten) stark. Das Material muss neuerlich synthetisiert werden, und neuerlich mit dem nun-akzeptierten Protokoll untersucht werden.
In den zukuenftigen Neusynthesen wird es eine betraechtliche Verbesserung der vielen Schritte geben, die oben beschrieben wurden. Das Produkt der Bereitung des Phenols, der Allylether, die Claisenumlagerung, die Methylierung eines neuen Phenols, und die Isomerisierung zu der Mischung aus cis- und trans-Propenylbenzols wurden alle ohne den Vorteil eines Kugelrohr Apparats durchgefuehrt. Das Produkt wurde zunehmend dicker und schwarzer, und es war nur der Gunst, einen Feststoff im trans-Propenylstadium zu erhalten, zu danken, dass ein gewisser Reinheitsgrad schliesslich erreicht werden konnte. Alle Zwischenprodukte sind sicherlich weisse Oele, und wenn diese Synthese wiederholt wird, werden sie bei jedem einzelnen Schritt destilliert werden.
Diese 2,3,5-Orientierung der Methoxygruppen am aromatischen Ring ist bei weitem das schwierigste tri-Substitutionsmuster, dass Chemikern bekannt ist. Es gibt keinen einfachen Weg es zusammenzusetzen. Das 2-Kohlenstoff Phenethylamin (2,3,5-Trimethoxyphenethylamin) wurde vor einiger Zeit synthetisiert. Seine Rolle als Substrat fuer die Leber Aminoxidase ist in 'in vitro' Studien untersucht worden, aber es wurde nie am Menschen probiert. Noch bizarrer ist das Amphetamin mit diesem Oxydationsmuster, in dem ein Methylendioxyring die 2 angrenzenden Methoxygruppen ersetzt hat. Dies ist die Droge 2,3-Methylendioxy-5-methoxyamphetamin, oder MMDA-4. Trotz seiner theoretischen Berufung, eines der 6 moeglichen MMDA Derivate zu sein und seiner synthetischen Herausforderung, ist die Verbindung von unbekannter Pharmakologie. Dies folgt der Tatsache, dass es nie synthetisiert worden ist. Niemand hat eine arbeitsfaehige Prozedur zusammengestellt, dass es machen wuerde. Mit dem Ziel alle moeglichen positionellen Isomere von MMDA explizit zu Klasse I Drogen zu machen, hat das DEA diese Verbindung benannt, und da es praezise benannt wurde, wurde es in die Chemical Abstracts hineingenommen. Aber in der Realitaet ist es komplett unbekannt. (42)
Synthese:
A. Shulgin gibt in seinem Buch "PHIKAL" folgendes Verfahren an, mit dem die Verbindung TMA-4 hergestellt wird:
Zu einer Loesung von 68g 2,4-Dimethoxybenzaldehyd in 250 ml Eisessigsaeure, die auf 25 Grad Celsius erwaermt und gut geruehrt wurde, wurden tropfenweise 86g einer 40%-igen Peressigsaeureloesung (in Essigsaeure) hinzugefuegt. Die Reaktion war exotherm. Die Rate der Addition wurde durch die Notwendigkeit diktiert, die Innentemperatur wenige Grade um 28 Grad Celsius zu halten. aeusseres Kuehlen wurde eingesetzt, wie noetig war. Die Addition dauerte 1h. Als die Reaktion eindeutig beendet war, (kein weiterer Temperaturanstieg) wurde die ganze Reaktionsmischung zu 3 Volumen H2O hinzugefuegt. Die ueberschuessige Saeure wurde mit festem K2CO3 (283g wurden gebraucht) neutralisiert. Dies wurde mit 3x100 ml Et2O extrahiert, die Extrakte vereint und vom Loesungsmittel im Vakuum befreit, um 66g rohes 2,4-Dimethoxyphenylformat zu ergeben. Dies wurde in 125 ml 10%-iger NaOH suspendiert. Die Mischung wurde am Dampfbad 1.5h lang erhitzt. Beim Abkuehlen bildete die Reaktionsmischung einen schweren, schwarzen Feststoff. Dieser wurde durch Filtration entfernt, mit H2O gewaschen und in 250 ml CH2Cl2 geloest. Die organische Phase wurde mit verd. HCl gewaschen, dann mit waessrigem NaHCO3, was viel von der Farbe entfernte. Entfernen des Loesungsmittels im Vakuum ergab tiefrotes, klebriges Zeug, dass in 200 ml wasserfreiem Et2O geloest und durch Papier filtriert wurde. Die resultierende klare Loesung wurde vom Loesungmittel befreit. Es ergab 34.4g 2,4-Dimethoxyphenol als rotes Oel, dass beim Abkuehlen kristallisierte. Ein 1g Beispiel in 4ml Pyridin wurde mit 0.9g Benzoylchlorid versetzt und am Dampfbad fuer wenige Min. erhitzt. Die Addition von H2O ergab einen pastetenartigen Feststoff, der durch Druecken auf eine poroese Platte isoliert wurde. Die Ausbeute an rohem 2,4-Dimethoxyphenylbenzoat war 1.1 g. Umkristallisieren aus Cyclohexan ergab ein weisses Produkt mit einem mp von 86-87 Grad Celsius. Eine zweite Umkristallisierung aus Cyclohexan hob diesen auf 89-90 Grad Celsius, was mit der Literatur uebereinstimmte.
Zu einer Loesung von 31g rohem 2,4-Dimethoxyphenol in 60 ml absolutem EtOH wurde eine Loesung von 11.25g KOH in 90 ml kochendem EtOH hinzugefuegt. Zu dem wurden dann 28g Allylbromid hinzugefuegt, was einen sofortigen weissen Niederschlag aus KBr erzeugte. Die Mischung wurde am Rueckfluss 2h lang gehalten und dann in 3 Volumen H2O geloescht. Genug 10%-ige NaOH wurde hinzugefuegt, um die Reaktion stark basisch zu machen. Dies wurde mit 3x100 ml Et2O extrahiert. Entfernen des Loesungsmittels im Vakuum ergab 33.2g 1-Allyloxy-2,4-dimethoxybenzol. Durch GC Analyse wurde festgestellt, dass dies frei vom beginnenden Phenolmaterial war. Analysen muessen bei niederen Saeulentemperaturen (unter 180 Grad Celsius), auf einem Ethylenglykolsuccinat-substrat, ausgefuehrt werden. Wenn eine Siliconsaeule gebraucht wird, auch bei diesen niederen Temperaturen, finden betraechtliche Claisenumlagerungen in der Saeule statt. Die Niedertemperatur-Destillation kann fuer weitere Reinigung verwendet werden (107-110 Grad Celsius bei 1mm/Hg).
Ein 31g Beispiel 1-Allyloxy-2,4-dimethoxybenzol wurde sanft mit einer offenen Flamme erhitzt, bis die interne Temperatur 215 Grad Celsius erreichte. Eine exotherme Reaktion lief ab, mit einer Temperatursteigerung bis auf 270 Grad Celsius. Der Rest, der im Kolben geblieben war, war hauptsaechlich 2-Allyl-4,6-dimethoxyphenol, dass vielleicht 10% 2,4-Dimethoxyphenol beinhaltete, welches durch pyrolytischen Verlust der Allylgruppe entstand. Die Mischung wurde ohne weitere Reinigung methyliert.
Zu einer Loesung von 30g unreinen 2-Allyl-4,6-dimethoxyphenol in wenig absolutem EtOH wurde eine kochende Loesung von 8.7g KOH in 75ml absolutem EtOH hinzugefuegt, sofort gefolgt von 22.4g Methyliodid in wenig EtOH. Die Mischung wurde 3h am Rueckfluss gehalten, dann zu 4 Volumen H2O hinzugefuegt. Genug 10%-ige NaOH wurde hinzugefuegt, um die Mischung stark basisch zu machen. Dies wurde mit 4x100 ml Et2O extrahiert. Entfernen des Loesungsmittels ergab 28 g 1-Allyl-2,3,5-trimethoxybenzol. GC Analyse zeigte rund 10% 1,2,4-Trimethoxybenzol, eine erwartete Unreinheit.
Zu einer Loesung aus 26g rohem 1-Allyl-2,3,5-trimethoxybenzol im gleichen Gewicht absolutem EtOH wurden 52g KOH Plaetzchen hinzugefuegt. Die Mischung wurde am Dampfbad uebernacht erhitzt, und dann mit viel H2O abgebrochen. Dies wurde mit 3x100 ml Et2O extrahiert, was beim Entfernen im Vakuum 24.6g Produkt ergab. Dies beinhaltete, durch GC Analyse festgestellt, hauptsaechlich cis- und trans-1-Propenyl-2,3,5-trimethoxybenzol und das erwartete 1,2,4-Trimethoxybenzol. Diese Mischung wurde im gleichen Volumen Pentan geloest, und in Trockeneis abgekuehlt. Schnelle Filtration ergab 9.2g bernsteinfarbenen Feststoff, der einen mp von 39-41.5 Grad Celsius hatte. Umkristallisieren aus Hexan ergab reines trans-1-Propenyl-2,3,5-trimethoxybenzol mit einem mp von 44-45 Grad Celsius. Verdunsten der originalen Pentanmutterfluessigkeit ergab ein unreines Beispiel gemischter cis- und trans-Isomere.
Eine Loesung von 7.2g trans-1-Propenyl-2,3,5-trimethoxybenzol in 41g trockenem Aceton wurde mit 3.3g trockenem Pyridin versetzt, und unter gutem Ruehren auf 0 Grad Celsius abgekuehlt. Es wurden dann 6.9g Tetranitromethan hinzugefuegt, verteilt auf 1 Min. Die Reaktionsmischung wurde fuer zusaetzliche 2 Min. geruehrt. Die Reaktion wurde dann mit einer Loesung von 2.2g KOH in 40 ml H2O abgebrochen. Nach Addition von mehr H2O, wurde das Produkt mit 3x50 ml CH2Cl2 extrahiert. Entfernen des Loesungsmittels im Vakuum ergab 7g unreines Produkt, welches nicht kristallisieren wuerde. Dieses wurde im Vakuum destilliert, um 4 Fraktionen zu ergeben, alle kristallisierten spontan. Fraktion #1 und #2 (bp 100-120 Grad Celsius und 120-130 Grad Celsius bei 2mm/Hg) wurden kombiniert, wogen 0.8g, und nach Kristallisation aus Hexan, ergaben sie weisse Kristalle mit einem mp von 62-63 Grad Celsius. Das NMR Spektrum (in CDCl3) stimmte mit 2,3,5-Trimethoxybenzaldehyd ueberein, und der Literatur mp war 62-63 Grad Celsius. Fraktion #3 und #4 (bp 130-170 Grad Celsius und 170-175 Grad Celsius bei 2mm/Hg mit der Hauptmenge in der letzen Fraktion) wurden vereint, um 3g gelbe Kristalle zu ergeben. Diese wurden unter wenig kaltem MeOH gemahlen, und dann aus MeOH umkristallisiert, um 1.15g gelbe Kristalle aus 2-Nitro-1-(2,3,5-trimethoxyphenyl)propen zu ergeben, mit einem mp von 87-88 Grad Celsius. Der Vorlauf der Destillation beinhaltete betraechtliche Mengen unverbrauchtes trans-1-Propenyl-2,3,5-trimethoxybenzol und etwas 1,2,4-Trimethoxybenzol, was durch GC Analyse festgestellt wurde.
Zu einer am Rueckfluss kochenden und geruehrten Suspension von 1.1g LAH in 150 ml wasserfreiem Et2O, unter einer Inertatmosphaere, wurde eine Loesung von 1.1g 2-Nitro-1-(2,3,5-trimethoxyphenyl)propen in 50 ml wasserfreiem Et2O hinzugefuegt. Die cremige Mischung wurde am Rueckfluss 4h lang gehalten und gekuehlt. Dann wurde das ueberschuessige Hydrid vorsichtig durch die Addition von 1.5N H2SO4 zerstoert. Es wurden dann 20g Kaliumnatriumtartrat hinzugefuegt, gefolgt von genug waessriger NaOH, um den pH-Wert auf >9 zu heben. Die Et2O Phase wurde abgetrennt, und die verbleibende waessrige Phase mit 3x75ml CH2Cl2 extrahiert. Die organische Phase und die Extrakte wurden vereint, das Loesungsmittel im Vakuum entfernt, was 0.9g farbloses Oel ergab. Dies wurde in 200 ml wasserfreiem Et2O geloest, der mit wasserfreiem HCl Gas gesaettigt war. Es wurde ein dickes Oel gebildet, dass nicht kristallisierte. Der Et2O wurde von diesem dekantiert, und fuer einige Tage in einem versiegelten Container bei Zimmertemperatur stehen gelassen. Es gab die Bildung von feinen weissen Nadeln aus TMA-4-HCl, die, nach Et2O Waschen und Lufttrocknen, 0.31g wogen. Der mp war 118-119 Grad Celsius. Anal. (C12H20ClNO3) C,H. Das restliche Oel wurde in H2O geloest, mit NaOH basisch gemacht, und mit CH2Cl2 extrahiert. Verdunsten des Loesungsmittels ergab 0.4g weisses Oel, welches in wenig MeOH geloest wurde, der 0.22g Oxalsaeure beinhaltete. Es gab sofort eine Ablagerung von Kristallen des Oxalatsalzes von TMA-4, mit einem mp von rund 110 Grad Celsius. (42)
Dosis:
Die Dosis soll groesser als 80 mg sein, behauptet A. Shulgin. (42)
Wirkdauer:
Vermutlich wirkt die Substanz 6h, wie A. Shulgin vermutet. (42)
Wirkungen:
A. Shulgin Verfasser des Werkes "PHIKAL" gibt folgende subjektive Wirkungsbeschreibung an:
80 mg: Ich war ueber 'Life' Ausgaben beunruhigt, mit viel Introspektion, rund 6h lang. Es gab keine subjektiven koerperlichen Symptome. Es war fuer mich vergleichbar mit rund 50mcg LSD, oder 120 mg TMA. (42)
Sucht:
Die Ausbildung einer koerperlichen Abhaengigkeit ist nicht bekannt. (eigen)