MMDA
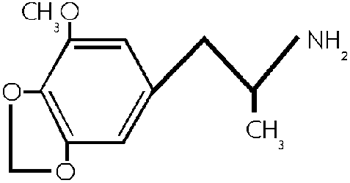
Formel aus:
(42)
Andere Namen:
3-Methoxy -4,5- methylen- dioxyphenyl -isopropylamin (36) 3-Methoxy -4,5- Methylendioxyamphetamin (25)
Allgemeines:
MMDA ist ein halluzinogenes Amphetamin, welches chemisch nahe mit MDA verwandt ist. Diese Verbindung unterscheidet sich von der chemisch nahe verwandten Substanz MDA lediglich durch das Vorhandensein einer zusaetzlichen Methoxygruppe. Es ist eine kuenstliche Verbindung, (13, 36) obwohl es dem aetherischen Oel Myristicin der Muskatnuss (Myristica fragrans) nachgebaut ist. Die enge Verwandschaft in chemischer Hinsicht, entspricht die eng verwandte Wirkung auf das Seelenleben des Menschen. (13)
Alexander Shulgin synthetisierte MMDA und beschrieb die Wirkungen und die chemische Synthese in "PIHKAL". (42)
Arman Sahihi, git folgende kurze Kommentare zu MMDA an:
Es ist psychoaktiv; waehrend MDA Erinnerungen an Vergangenes aktiviert und Vergessenes freilegt, verstaerkt MMDA gegenwaertige Neigungen und Gefuehle; haeufig verwendet in der Psychotherapeutie; am Schwarzmarkt faelschlicherweise unter dem Namen Ecstasy und XTC angeboten, (36) was korrekterweise MDMA sein sollte! (eigen)
Wirkungen:
Beim Vergleich mit anderen psychoaktiven Drogen charakterisierte Naranjo den Bereich von MMDA ausgeloesten visionaeren Erfahrung, als im Bereich liebender Verklaerung. "Wie MDA gehoert auch MMDA einer Kategorie der Rauschdrogen an, die sich von LSD und Meskalin, von Harmalin und Ibogain grundlegend unterscheidet. Im Gegensatz zu der fuer diese beiden Drogengruppen charakteristischen Erfahrung im Bereich des Ueberpersonalen und Unbekannten", schreibt Naranjo,"fuehren die GEFUEHLSSTEIGERNDEN Isopropylamine von MDA und MMDA den Betreffenden in personale und vertraute Bereiche, die sich vom Alltag lediglich dadurch unterscheiden, dass sie mit einer weit groesseren Intensitaet erlebt werden. (13)
Es gibt eine Theorie, naemlich dass Myristicin, der Hauptinhaltsstoff der Muskatnuss (Myristica fragrans) im Koerper des Menschen zu MMDA aminisiert wird, d.h. der Koerper erzeugt MMDA, wenn man Myristicin zu sich nimmt. Demnach waere MMDA die eigentlich wirksame Verbindung der Muskatnuss. (13)
Sucht:
Die Ausbildung einer koerperlichen Abhaengigkeit ist nicht bekannt geworden. (eigen)
Dosis:
A. Shulgin gibt die Dosis der Verbindung, in der sie halluzinogen wirkt, mit 100-250 mg an. (42)
Wirkdauer:
Die Wirkdauer ist nach A. Shulgin gering. (42)
Synthese:
- A. von Protocatechualdehyd
Eine Loesung von 18g kommerziell erhaeltlichem Protocatechualdehyd (3,4-Dihydroxybenzaldehyd) in 200 ml warmer Essigsaeure wurde filtriert, um alle unloeslichen Substanzen fuer eine sehr dunkle aber klare Loesung zu entfernen. Mit kraeftigem Ruehren wurde 20g
elementares Brom hinzugefuegt. Die Reaktionsmischung erwaermte sich ploetzlich um mehr als 30 Grad Celsius. Feststoffe erschienen in rund 5 Min. Das Ruehren wurde fuer 1h fortgesetzt, worauf die leicht grauen Feststoffe durch Filtration abgetrennt und ein wenig mit
Essigsaeure gewaschen wurden. Nun wurde auf dem Dampfbad luftgetrocknet, bis die freie Essigsaeure riechbar wurde. Das Produkt, 3-Brom -4,5- dihydroxybenzaldehyd, wog 11,7g und hatte einen mp von 222 Grad Celsius.
Zu einer Loesung von 11,7g 3-Brom -4,5- dihydroxybenzaldehyd in 36ml DMSO wurden 29g Methyleniodid hinzugefuegt, gefolgt von 20,8g wasserfreiem K2CO3. Diese Mischung wurde auf dem Dampfbad fuer 3h erhitzt, zu 1l H20 gefuegt, stark basisch gemacht mit NaOH, dann mit 3x100 ml CH2Cl2 extrahiert. Die gesammelten Extrakte wurden mit H20 gewaschen und das Loesungsmittel unter Vakuum entfernt. Der dunkelbraune halbfeste Rest wurde destilliert, wobei die Hauptfraktion (6g) bei 120-130 Grad Celsius und einem Druck von 0,3 mm/Hg ueberging. Dies wurde nach Umkristallisieren aus 35g kochendem Methanol, als 1,3g 3-Brom-4,5-methylendioxybenzaldehyd in Form weisser Kristalle erhalten, die einen mp von 123-124 Grad Celsius hatten.
Eine Mischung aus 2,2g 3-Brom -4,5- methylendioxybenzaldehyd und 3,6ml Cyclohexylamin wurde in einem Destillationskolben auf 100 Grad Celsius erhitzt, um die Aufloesung zu bewirken. Dann wurde mit offener Flamme erwaermt, bis die Bildung von H20 ersichtlich wurde. Alles wurde nun unter hartes Vakuum gebracht, um das generierte Wasser und ueberschuessiges Cyclohexylamin zu entfernen. Das Produkt wurde bei 120-125 Grad Celsius und einem Druck von 0,2mm/Hg destilliert. Es wurden 2,4g der Schiff'schen Base des Aldehyds und des Amins erhalten, mit einem mp von 86-96 Grad Celsius. Umkristallisierung eines analytischen Beispiels aus 5 Volumen Methanol ergab 3-Brom -4,5- methylendioxybenylidin -N- cyclohexylamin als einen weissen Feststoff mit einem mp von 97,5-98,5 Grad Celsius.
Eine Loesung von 2,2g 3-Brom -4,5- methylendioxybenyliden -N- cyclohexylamin (obige Schiff'sche Base) in 50 ml wasserfreien Diethylether wurde in eine Heliumatmosphaere gegeben, magnetisch geruehrt, und mit einem Trockeneis/Aceton-Bad gekuehlt. Eine weisse fein-kristalline Phase erschien. Darauf wurden 5,2ml 1.55M Butyllithium in Hexan zugefuegt (die feinen Niederschlaege entschwanden) gefolgt von von 4ml Tributylborat. Nachdemaufe Loesung zur Raumtemperatur zurueckgekehrt war, wurde die Reaktion mit 20 ml gesaettigter waessriger Ammoniumsulfatloesung angehalten. Die Ether/Hexan Schicht wurde abgetrennt, mit zusaetzlicher Ammoniumsulfatloesung gewaschen, und dann von allen fluechtigen Stoffen unter Vakuum befreit. Der Rest wurde in 100 ml 50%-igem MeOH geloest, mit 2ml 30%-igem Wasserstoffperoxid behandelt. Dann wird 15 Min. gewirbelt und mit einer Loesung von 10g Ammoniumsulfat in 50 ml H20 abgebrochen. Die waessrige Schicht (ph ~8) wurde mit 2x50 ml CH2CL2 extrahiert. Die zusammengefassten Extrakte wurden unter Vakuum von Fluechtigen befreit. Der Rest wurde in warmer, verd. HCl geloest. Nachdem sich der Rest geloest hatte (einige wenige Min. erhitzen genuegten), wurde die Loesung auf Raumtemperatur abgekuehlt und mit 2x50 ml CH2CL2 extrahiert. Diese Organika wurden gesammelt und mit 2x50 ml 5%-iger NaOH extrahiert. Ansaeuerung der gesammelten, waessrigen Extrakte mit HCl, gefolgt von Extraktion mit 2x50 ml CH2Cl2 ergab, nach Verdunsten des Loesungsmittels, einen Rest, welcher bei 140-150 Grad Celsius bei einem Druck von 0,25mm/Hg destilliert wurde, um 3-Hydroxy -4,5- methylendioxybenzaldehyd zu erhalten. Dieser wurde aus Toloul (40 ml/g) umkristallisiert, um 0,46g eines weissen Produkts mit einem mp von 134-134,5 Grad Celsius zu erhalten.
Eine Loesung von 0,44g 3-Hydroxy -4,5- methylendioxy -benzaldehyd in 10 ml trockenem Aceton wurde mit 0,5g Methyliodid und 0,5g gepulvertem, wasserfreien K2CO3 behandelt, und fuer 6h am Rueckflus gekocht. Alle fluechtigen Stoffe wurden unter Vakuum entfernt. Der Rest wurde in Wasser geloest, stark basisch gemacht mit NaOH, und darauf mit 3x50 ml CH2Cl2 extrahiert. Das Entfernen des Loesungsmittels ergab Myristicinaldehyd (mp 133-134 Grad Celsius), welcher nach Umkristallisieren aus Hexan eine Endausbeute von 0,42g, mit einem mp von 134-135 Grad Celsius, ergab.
Eine Loesung von 9,8g Myristinaldehyd in 35ml Eisessigsaeure wurde mit 5,3ml Nitroethan und 3,2g wasserfreiem Ammoniumacetat behandelt, und auf dem Dampfbad fuer 1,5h erhitzt. Es wurde entfernt, mit Wasser behandelt mit kraeftigem Ruehren, um das Verdicken zu verhindern, mit einem Samen des Produkts Nitrostyren versetzt, und langsam wieder auf Raumtemperatur abgekuehlt. Die hellgelben Feststoffe, die sich bildeten, wurden durch Filtration entfernt, mit einer kleinen Menge waesriger Essigsaeure gewaschen, und vom Loesungsmittel abgesaugt, soviel wie ging. Dieses Material, auf eine poroese Platte gepresst, hat einen mp von 107-110 Grad Celsius. Umkristallisieren von 60 ml kochendem Ethanol ergab, nach filtrieren und luftrocknen 5,1g 1-(3-Methoxy -4,5- methylendioxyphenyl) -2- nitropropen als leicht gelbe Feststoffe mit einen mp von 109-110 Grad Celsius.
Eine Suspension von 7,5g LAH in 500 ml wasserfreiem Ether wurde mit dem Magnetruehrer geruehrt, und in einer Inertatmosphaere erhitzt, bis sie vorsichtig am Rueckfluss kochte. Der kondensierte Ether leckte an 9,8g 1-(3-methoxy -4,5- methylendioxyphenyl) -2- nitropropen in einem Soxhletaufsatz. Dies fuegte das Nitrostyren zu der Reaktionsmischung als warme gesaettigte Etherloesung. Wenn die Addition fertig war, wurde das Rueckflusskochen noch fuer zusaetzliche 5h fortgesetzt. Dann wurde die Reaktionsmischung gekuehlt. Das ueberschuessige Hydrid wurde durch die Zufuegung von 400 ml 1,5N H2SO4 (bei den ersten 20 ml: 1 Tropfen und dann Ruehren) zerstoert. Die Schichten wurden getrennt. Es wurde genuegend gesaettigte, waessrige Na2CO3-Loesung zur waessrigen Loesung gegeben, um den ph-Wert auf 6 einzustellen. Dies wurde auf 80 Grad Celsius erhitzt, darauf durch eine grob gesinterte Glasfilternutsche filtriert, um feine unloesliche Stoffe abzutrennen. Das klare Filtrat wurde beinahe zum Kochen gebracht, und mit 10,2g einer 90%-igen Pikrinsaeureloesung in 110 ml kochendem EtOH behandelt. Kristalle des Pikrats bildeten sich ploetzlich an den Ecken. Der Reaktionskolben wurde in einem Eisbad gekuehlt. Die ganze Reaktion ergab einen gelben Haufen Kristalle. Diese wurden durch Filtration entfernt, mit wenig 80%-igen EtOH gewaschen, luftgetrocknet, um 14g des Pikratsalzes von MMDA, mit einem mp von 182-184 Grad Celsius, zu erhalten. Nach dem Umkristallisieren eines kleinen Beispiels aus EtOH fiel der mp auf 179-181 Grad Celsius. Das Salz wurde mit 30 ml 5%-igen NaOH behandelt. Die rote Loesung wurde von Unloeslichem dekantiert. Zusaetzliches H2O und NaOH loesten alles, und die resultierende basische, waessrige Schicht wurde mit 3x50 ml Dichlormethan extrahiert. Die gesammelten Extrakte wurden unter Vakuum vom Loesungsmittel befreit. Der Rest wurde in 200 ml wasserfreiem Ether geloest und mit wasserfreiem HCl-Gas gesaettigt. Es gab einen heftigen Niederschlag von weissen Kristallen, welche durch Filtration entfernt wurden, mit Ether gewaschen und luftgetrocknet, um 6,37g MMDA-HCl, mit einem mp von 190-191 Grad Celsius, zu ergeben. Anal. (C11H16ClNO3)Cl.
- B. aus Muskatnussoel
Die vorsichtige Destillation des Muskatnussoels (oder dem Oel der Macis) erlaubte die Trennung in eine Anzahl von Verbindungen in verschiedenartigen Reinheitsstufen. Die Fraktion, welche bei 110-115 Grad Celsius und 1mm/Hg kochte, war Myristicin
(3-Methoxy -4,5- methylendioxyallylbenzol). Es waren etwa 7% des originalen, kommerziell erhaeltlichen Oeles. Man erhielt es durch obiges Verfahren mit einer Reinheit von 87%. Der Hauptverunreiniger war Elemicin (3,4,5-Trimethoxyallylbenzol). Eine Loesung von
100g Myristicin in 100g absolutem Ethanol wurde mit 200g festen KOH versetzt und am Dampfbad ueber Nacht erhitzt. Das Entfernen der fluechtigen Verbindungen unter Vakuum, gefolgt von Fluten mit H2O, und Extraktion mit 3x100 ml CH2Cl2 ergab, nach Entfernen
des Loesungsmittels aus den kombinierten Extrakten, einen Rest rohen Isomyristicins. (eine Mischung des cis- und trans-Isomers). Dieses Produkt wurde destilliert. Die Fraktion, welche bei 125-130 Grad Celsius bei einem Druck von 1mm/Hg ueberging, ergab 63g
Isomyristicin, als ein blassgelbes Oel, dass ploetzlich kristallisierte. Der mp war bei 41,5-42,5 Grad Celsius. Eine Loesung von 50g Isomyristicin in 300 ml trocknem Aceton, welche 24g Pyridin beinhaltete, wurde kraeftig geruehrt und bis auf 0 Grad Celsius mit einem Eisbad abgekuehlt.
Das Ruehren wurde genau 2 Min. fortgesetzt. Zudem wurden 54g Tetranitromethan hinzugefuegt, die zuvor auf 0 Grad Celsius abgekuehlt worden waren. Dann wurde die Reaktion durch Zufuegung einer kalten Loesung von 16.8g KOH in 300 ml H2O unterdrueckt. Das Ruehren wurde fortgesetzt, bis die Temperatur erneut auf 0 Grad Celsius gefallen war. Das Produkt wurde durch Filtration
entfernt. Die Extraktion des Filtrats mit CH2Cl2 und das Beseitigen des Loesungsmittels ergaben zusaetzliches Nitrostyren, fuer eine kombinierte Ausbeute von 50.7g, mit einem mp von 103 Grad Celsius durch die Praesenz einer kleinen Menge freien Myristinaldehyds. Eine
Umkristallisierung aus MeOH produzierte 1- (3-Methoxy -4,5- methylendioxyphenyl) -2- nitropropen mit einem mp von 109-110 Grad Celsius.
Eine Mischung aus 50g 1- (3-methoxy -4,5- methylendioxyphenyl) -2- nitropropen und 26g razematischen alpha-Methylbenzylamin wurde auf dem Dampfbad erhitzt. Die Mischung bildete eine klare Loesung mit der Bildung von Nitroethan. Wenn die Reaktion ruhig geworden war, wurde eine Mischung von 20 ml konz. HCl in 100 ml H2O zugefuegt. Die Reaktionsmischung loeste sich ganz auf. Als die Temperatur stieg, kam es ploetzlich zur Verfestigung des gebildeten Myristinaldehyd als Kristalle. Das Produkt wurde durch Filtration entfernt. Kombiniert mit dem zweiten Extrakt, welcher durch Hexanextraktion des Filtrates entstand, ergaben sich 36,9g Myristinaldehyd. Der mp von 128-129 Grad Celsius wurde durch Umkristallisieren aus Hexan auf 133-134 Grad Celsius erhoeht. (42)
1962: A. Shulgin soll aus Myristicin aus dem aromatischen Oel der Muskatnuss und der Muskatbluete MMDA erstellt haben. (49/290)